稳定性分析
稳定性分析用于设置医药产品的失效日期。拟合了三个线性退化模型,并且根据以下 ICH (ICH Q1E 2003) 指导原则估计失效日期。ICH 指导原则用于确定批次是否可以合并的一般框架。有关具体实施细节,请参见 Chow(2007,附录 B)中的 STAB 宏和 FDA 指导原则。
这三个模型如下所示:
模型 I
不同批次使用不同的斜率和不同的截距。
模型 II
不同批次使用共同斜率和不同的截距。
模型 III
不同批次使用共同斜率和共同截距。
通过以下过程确定推荐的模型:
1. “模型 I”按时间效应、批次效应和交互作用依次进入模型的方式来拟合。使用 I 型(序贯)平方和,检验斜率是否相等(输出中的“源 C”)。
‒ 若 p 值小于 0.25,则假定斜率在不同批次之间是不同的。该过程将停止,并使用“模型 I”来估计失效日期。
‒ 若 p 值大于等于 0.25,则假定斜率在不同批次之间是相同的。该过程继续前进到步骤 2。
2. 若步骤 1 得出的结论是斜率是共同的,则使用“模型 II”中的 I 型(序贯)平方和来检验截距是否相等(输出中的“源 B”)。
‒ 若 p 值小于 0.25,则假定截距在不同批次之间是不同的,并且使用“模型 II”来估计失效日期。
‒ 若 p 值大于等于 0.25,则假定截距在不同批次之间是相同的,并且使用“模型 III”来估计失效日期。
使用“模型 I”(不同的斜率和不同的截距)来估计失效日期时,不合并不同批次的 MSE(均方误差)。使用各均方误差为每个批次计算预测区间,并且使用最先跨越规格限的区间来估计失效日期。
警告:“退化数据分析”报表中“残差图”下方的模型的编码不一定与“稳定性检验”报表中的模型顺序相对应。默认情况下,“模型 1”使用合并标准误差,在“稳定性检验”报表中不引用“模型 1”。“模型 2”等同于“稳定性检验”报表中的“模型 II”。“模型 3”等同于“稳定性检验”报表中的“模型 III”。“模型 4”等同于“稳定性检验”报表中的“模型 I”。若在请求“稳定性检验”选项之前或之后拟合了任何其他模型,这种模型编号对等方式可能不成立。
示例
考虑 Stability.jmp 样本数据表。该数据包含四个批次的产品浓度测量值。浓度为 95 被视为产品的可使用性的结束。使用该数据可确立新产品的失效日期。
要执行稳定性分析,请执行以下步骤:
1. 选择帮助 > 样本数据库,然后打开 Reliability/Stability.jmp。
2. 选择分析 > 可靠性和生存 > 退化。
3. 选择稳定性检验选项卡。
4. 选择浓度(毫克/千克)并点击 Y,响应。
5. 选择时间并点击时间。
6. 选择批次编号并点击标签,系统 ID。
7. 对“下规格限”输入 95。
8. 点击确定。
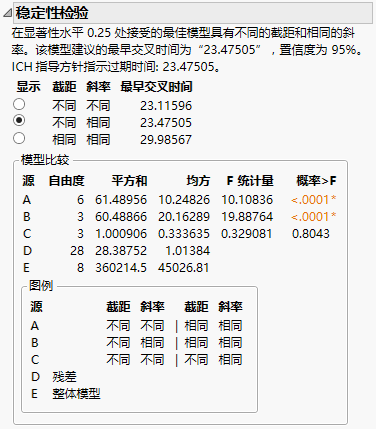
图 7.24 稳定性模型
等斜率检验的 p 值为 0.8043。由于该值大于显著性水平 0.25,所以未拒绝该检验,您可以得出结论:退化斜率在不同批次之间是相等的。
等截距和等斜率检验的 p 值 <.0001。由于该值小于显著性水平 0.25,所以拒绝该检验,您可以得出结论:截距在不同批次之间是不同的。
由于未拒绝等斜率检验,但拒绝了等截距检验,所以所选模型是具有“不同截距”和“共同斜率”的模型。该模型是在报表中选定的模型,并且提供估计的失效日期为 23.475。