Warum nimmt der Einsatz risikobasierter Überwachung zu?
Risikobasierte Überwachung für klinische Studien
Was ist risikobasierte Überwachung?
Risikobasierte Überwachung ist der Prozess der Qualitätssicherung klinischer Studien durch Identifikation, Bewertung, Überwachung und Beschränkung der Risiken, die die Qualität und Sicherheit einer Studie beeinträchtigen können. Die Richtlinie der US-amerikanischen Nahrungs- und Arzneimittelbehörde (US Food and Drug Administration, FDA) nennt drei Schritte eines risikobasierten Überwachungsansatzes:
- Erkennen kritischer Daten und Prozesse. Zur präzisen Überwachung der Qualität einer Studie und der Sicherheit der jeweiligen Teilnehmer muss der Sponsor wissen, welche Elemente für die jeweilige Studie besonders wichtig sind – von der Einverständniserklärung bis zur Patientenrekrutierung und Nachverfolgung von Nebenwirkungen.
- Durchführen einer Risikoabschätzung. Zur Risikoabschätzung gehört das Bestimmen spezieller Risikoquellen und der Auswirkungen von Studienfehlern auf diese Risiken.
- Entwickeln eines Überwachungsplans. Laut FDA-Richtlinien sollte ein Überwachungsplan „die Überwachungsmethoden, Verantwortlichkeiten und Anforderungen der Studie beschreiben“. Der Plan muss die Risiken und Überwachungsverfahren für alle an der Studienüberwachung beteiligten Personen darlegen.
Warum nimmt der Einsatz risikobasierter Überwachung zu?
Kosten und Komplexität klinischer Studien haben in den letzten Jahren dramatisch zugenommen. Bis zu einem Drittel der Studienkosten lassen sich der herkömmlichen Prüfung der Studiendaten vor Ort zuordnen.
Dieser Ansatz ist auf umfangreiche Quelldatenprüfungen angewiesen und nicht nur ressourcenintensiv, sondern auch in seinen Möglichkeiten der Identifikation und Vermeidung von Problemen begrenzt.
Da wirksame Überwachung für den Schutz des Wohlbefindens der Studienteilnehmer und die Integrität der Endergebnisse unerlässlich ist, hat sich die Auffassung durchgesetzt, dass Änderungen am Prozess der Überwachung klinischer Studien erforderlich sind.
Mehrere Aufsichtsbehörden, einschließlich der FDA, bevorzugen nun einen zentralisierten, risikobasierten Ansatz als Überwachungsmethode klinischer Studien.
Warum ist ein solcher Ansatz besser?
Ein wesentliches Merkmal risikobasierter Überwachung ist der Einsatz zentralisierter Überwachungstechniken. Im Gegensatz zur Vor-Ort-Überwachung, die auf der Überprüfung aller Quelldaten basiert, verspricht zentralisierte Überwachung eine Reihe von Vorteilen:
- Weniger Fehler. Vor-Ort-Überwachungsmethoden sind, wie jede manuelle Arbeit, in ihrem Umfang begrenzt und fehleranfällig. Risikobasierte, zentralisierte Überwachung verwendet mehr automatisierte Prüfungen, um zu ermitteln, ob manuelle Eingriffe nötig sind, und verfügt über eine höhere Wahrscheinlichkeit der Fehlererkennung.
- Niedrigere Kosten. Mit zentralisierter Überwachung, können Tätigkeiten wie Vor-Ort-Prüfungen auf Studien-Standorte eingeschränkt werden, an denen höchstwahrscheinlich Probleme auftreten. Und das kann die Überwachungskosten drastisch reduzieren.
- Bessere Analyse. Da alle Daten in ein zentrales Risiko-Dashboard einfließen, lassen sich statistische und graphische Prüfungen zur Feststellung von Ausreißern und ungewöhnlichen Mustern in den Daten viel leichter durchführen.
- Standortübergreifender Vergleich. Zentralisierte Überwachung ermöglicht auch den Vergleich von Daten einzelner Standorte untereinander für die Bewertung der Leistung, die Identifikation potenziell betrügerischer Daten und die Lokalisierung defekter oder schlecht kalibrierter Ausrüstung.
- Zeitnähere Ergebnisse. Ein Dashboard ermöglicht auch die Identifikation und Lösung von Problemen während der Studie.
Der Überwachungsprozess
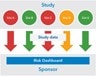
Die FDA hat, wie bereits erwähnt, detaillierte Richtlinien zur Vorbereitung eines Überwachungsplans erstellt. Existiert ein solcher Plan einmal, liegt dessen Umsetzung in der Verantwortung des Sponsors (oder des Bevollmächtigten des Sponsors, etwa eines CRO). Auch wenn sich Studien im Einzelnen deutlich voneinander unterscheiden, enthält ein risikoorientiertes Überwachungsprogramm im Allgemeinen die folgenden Tätigkeiten, die in ein umfassendes, für Ihre spezielle Studie erstelltes Risiko-Dashboard einfließen:
- Datenerfassung und -übermittlung. Ein zentralisierter Ansatz erfordert einen konstanten und zuverlässigen Datenfluss von jedem Studien-Standort zum zentralen Überwachungssystem. Das kann entweder durch manuelle Eingabe relevanter Daten und deren Übermittlung oder über eine automatisierte Verbindung zwischen dem Dateneingabesystem und dem zentralen Dashboard erfolgen.
- Dashboard-Überwachung. Die Funktion des Dashboards besteht darin, die Informationen über den Status jedes Studien-Standorts in Hinsicht auf spezifische Risikofaktoren in Ihrer Studie auf einen Blick bereitzustellen. Wenn ein Standort ein hohes Risikoniveau aufweist, sollte der Überwachungsplan Ihnen helfen zu entscheiden, ob weitere Untersuchungen angebracht sind, von tiefgehenden statistischen Analysen bis zur Datenüberprüfung vor Ort.
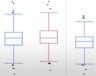
- Statistische Analyse. Es kann auch nützlich sein, zusätzlich zur Überwachung des Dashboards statistische Analysen durchzuführen, die bei der Identifikation von Problemen hilfreich sind. Einfache Histogramme und Box-Plots können für das Erkennen von Ausreißern zwischen Standorten oder Ländern für verschiedene Risikoindikatoren äußerst nützlich sein. Komplexere Verfahren wie Clustern können auch für die Identifikation problematischer Standorte oder sogar von Betrug hilfreich sein.
- Gezielte Untersuchung vor Ort. Die Dashboard-Überwachung und weitere Analysen zeigen bisweilen deutlich die Notwendigkeit persönlicher Untersuchungen an einem bestimmten Studien-Standort. In solchen Fällen können ein Besuch vor Ort und die Durchführung einer eher herkömmlichen, der Art Ihrer Studie entsprechenden Quelldatenüberprüfung angebracht sein. Der Hauptpunkt ist, dass Untersuchungen vor Ort, sobald es ein zentralisiertes System gibt, die Ausnahme und nicht die Regel sein sollten.
Das Risiko-Dashboard
Das Risiko-Dashboard selbst ist das Zentrum eines risikobasierten Überwachungsprogramms. Alle Studiendaten sollten in das Dashboard eingespeist werden, und das Dashboard sollte so konzipiert sein, dass es deutliche visuelle Hinweise auf Studien-Standorte mit hohem Risiko bietet.
Zur Erleichterung der Erstellung dieser visuellen Hinweise definiert ein Überwachungsplan häufig Schwellenwerte für bestimmte Risikoindikatoren, die den jeweiligen Indikator als schwach, mittel oder schwerwiegend klassifizieren. Anhand dieser Schwellenwerte können Sie eine Farbkodierung für Ihr Dashboard erstellen, die die Risikoniveaus nach Standort oder auch nach Land zusammenfassen.
Es ist auch möglich, neben der Grundfunktion des Risiko-Dashboards die Datenanzeige anzupassen und rasch weitere Analysen durchzuführen. Die Analysten können mehrere Sets von Risiko-Schwellenwerten zur Bewertung der Sensitivität ihrer Ergebnisse definieren. Sie können auch Kennzahlen für das Gesamtrisiko berechnen, die ihnen erlauben, die Gesamtleistung eines Standorts oder eines Landes einzuschätzen.
Wo beginnen: Der Umgang mit organisatorischen Veränderungen
Obwohl es in der Branche eine lebhafte Diskussion – und zunehmende Einigkeit – über die Vorteile eines risikobasierten Ansatzes gibt, werden diese Verfahren nur langsam aufgegriffen. Natürlich sind die Kosten eines Umstiegs auf stärker zentralisierte Überwachung hoch: Verfügen Sie über die für zentrale Überwachung erforderlichen analytischen Fachkenntnisse? Verfügen Sie über die Werkzeuge zum Erstellen eines nützlichen Dashboards? Wie erfassen Sie die Daten der Studien-Standorte und wie übertragen Sie sie? Was geschieht mit den Leuten, die heute Prüfungen vor Ort durchführen?
Letzten Endes ist das Umsteigen auf risikobasierte Überwachung möglicherweise einfacher, als Sie glauben, und manche Werkzeuge sind überraschend leicht zu bedienen. Hier ein paar nützliche Punkte für den Einstieg:
- Suchen Sie einen Vorkämpfer und einen Executive Sponsor.
Eine große organisatorische Umstellung kann ohne einen internen Vorkämpfer und einen Executive Sponsor nicht gelingen. Manchmal kann eine Person beide Rollen übernehmen, oft aber ist der Vorkämpfer jemand aus der Praxis, die die Notwendigkeit einer Veränderung erkannt hat, deren Potenzial sieht und einen Executive Sponsor von der Idee überzeugt. Der Executive Sponsor räumt dann die Hindernisse für die Durchführung aus dem Weg. - Besorgen Sie sich die richtigen Werkzeuge.
Möglicherweise sind für die Zentralisierung der Überwachung zahlreiche Technologien nötig. Am besten fängt man jedoch mit Werkzeugen an, die schnelle, visuelle Ergebnisse liefern und keine umfangreiche Datenbank, Programmierung oder Statistikerfahrung erfordern. Diese Fertigkeiten sind sicher hilfreich, aber sie sollten nicht Voraussetzung für den Start sein. - Fangen Sie klein an.
Wenn Sie den grundlegenden Überwachungsprozess konzipieren und die erforderlichen Werkzeuge installiert haben, versuchen Sie, Ihre Risikoabschätzung und die zentralisierte Überwachung mit einer Einzelstudie oder einer kleinen Gruppe von Studien zu beginnen. Das reduziert die erforderlichen Ressourcen und bietet Ihrer Organisation die Möglichkeit, sich auf den Umstieg vorzubereiten. - Lassen Sie das Projekt organisch wachsen.
Wenn Sie klein anfangen, haben Sie auch Gelegenheit, die Schwachstellen in Ihrem Überwachungsprozess zu korrigieren. Der Prozess sollte mit jeder Iteration reibungsloser werden, das vereinfacht die Skalierung auf immer mehr Studien. Diese Herangehensweise ist deutlich weniger einschüchternd als ein einzelner, dramatischer Wechsel, und die Möglichkeit, bei der Anwendung zu lernen, sollte zu besseren Prozessen führen, die sich effizienter skalieren lassen.
Der Umstieg auf eine stärker zentralisierte Überwachung bietet echte Herausforderungen – aber der Umstieg findet statt, gleichgültig, wo Sie beginnen und wie vorsichtig Ihre Organisation das Konzept angeht. Und es ist besser, ganz vorne dabei zu sein, als zurückzufallen, insbesondere in einer Branche, in der sich alles um die Zeit bis zur Marktreife dreht.