基礎研究・非臨床試験
医薬品開発
医薬品開発には、基礎研究、非臨床試験、臨床試験、承認後の医薬品の製造、製造販売後というフェーズがあります。
各フェーズでは、候補物質や原薬、医薬品などの有効性、安全性、そして品質を客観的に評価するため、データを収集し解析を実施する必要があります。
JMP製品は、医薬品開発のすべてのフェーズにおけるデータ解析を強力にサポートします。
必見!無料ホワイトペーパー
基礎研究・非臨床試験
医薬品候補を見出す基礎研究、医薬品候補物質の安全性を検討する非臨床試験では、統計的手法の利用により、客観的な評価、品質の保証が可能です。JMP製品は基礎研究、非臨床試験のさまざまな場面でのデータ解析を強力にサポートします。
主な用途
- 原薬、製剤研究、または探索研究における実験計画法(DoE)の利用
- 原薬プロセス開発、製剤開発における製造パラメータのスクリーニング、最適化、デザインスペースの作成
- Analytical QbDに基づく原薬、製剤の分析法(メソッド)開発
- 細胞培養プロセス開発(培地法検討、精製法検討など)
- 配合物の最適割合の決定
- 非臨床試験における統計解析
- 量的、質的な特性値(薬理パラメータなど)の群間比較、反復測定の解析
- 非線形モデルのあてはめ(薬理モデル、薬物動態モデル、検量線の作成など)
- プロビット法、ロジスティック法などによる毒性試験のIC50、LD50の算出
- サンプルサイズ設計、割付け
- 安定性試験による医薬品の有効期間の算出
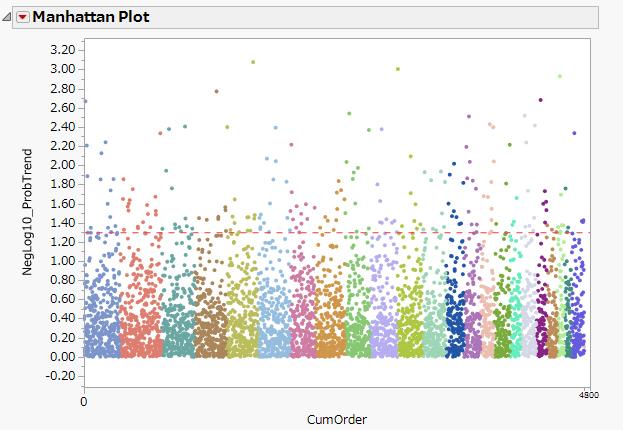
- ゲノム解析によるバイオマーカーの発見
- 化合物の活性や毒性を物性値から予測する統計モデリング
臨床試験
規制当局への「臨床試験CDISC標準データ提出」が始まり、さらなるCDISCデータの利用、活用が求められています。
JMP Clinicalでは、SDTM、ADaMのデータセットを登録し、簡単にデータをレビューすることができます。
主な用途
- 臨床試験データのレビュー、解析
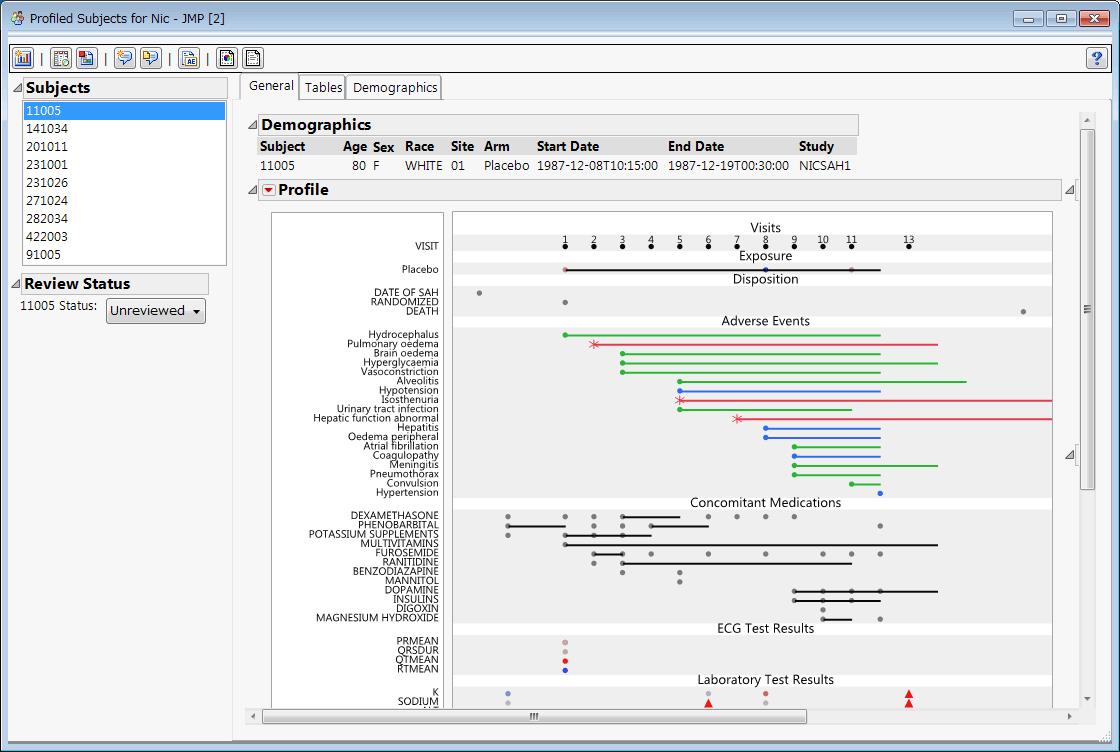
- 被験者特性、有害事象、臨床検査値などのグラフ化、傾向の把握
- データのフィルタリングによる部分集団解析
- 解析レポートのドリルダウン
- 被験者プロファイル、有害事象ナラティブの作成
- リスクベースモニタリング(RBM)
- 施設間で有害事象、転帰などのリスクを評価するセントラライズドモニタリングの実施
- 統計的手法を用いたデータの品質管理、不正検出
- 同等性試験の解析(クロスオーバー法)
製造・販売後
医薬品の申請、承認後にも、製造販売後(市販後)調査のデータ、製造データ、マーケットデータなど、さまざまなデータが収集されます。
JMP製品は、これらのデータに対しても、効率的かつ効果的に可視化、解析を行なうことができます。
主な用途
- 医薬品製造過程における品質管理、不良品削減、リスクの最小化、工程の効率化、および生産性向上
- 管理図やデザインスペース等を用いた工程のモニタリング
- 統計モデルの作成、要因分析、予測
- 信頼性解析
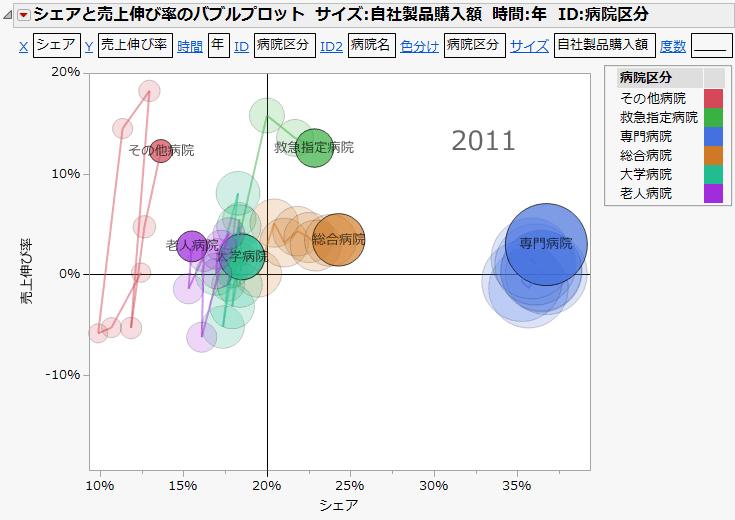
- 市場調査、マーケティング調査における解析
- アンケート調査の解析
- 医薬品市場調査データの解析
- 製造販売後調査、臨床研究における統計解析
- 大規模データの解析
- ファーマコビジランス部門で扱う安全性データの解析
- メディカルアフェアーズ部門で扱う副作用データの加工、集計、統計解析
- レセプト、DPCデータなどリアルワールドデータ(RWD)の加工、集計、統計解析、機械学習
関連情報:JMP製品の品質について
JMPの品質に関する記述があり、以下の関連ドキュメント、プログラムがダウンロード可能です。
- JMPの開発プロセス、品質に関するホワイトペーパー
- 数値解析精度をNISTが提供するプログラムとの比較により検証するホワイトペーパー
- インストールのバリデーションプログラム(IQ)、NISTテストを実施するプログラム(OQ)の提供